BACE1是Aβ生成的限速酶。在淀粉样前体蛋白的加工过程中,APP分别被γ-分泌酶和β-分泌酶所降解,生成Aβ片段
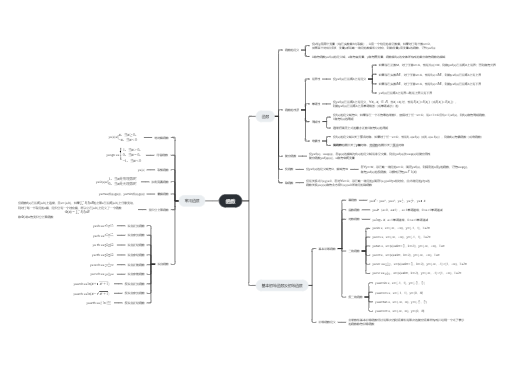
脑脊液中Aβ42 表达变化可以反映纤维状Aβ含量的变化,从而间接反映Aβ斑块在脑组织的负荷状态
在AD和其他神经退行性疾病的病理生理学中,由于中枢神经的炎症作用,神经炎症生物标志物越来越受重视。YKL-40在细胞的各种反应中扮演着不同的角色-主要为增殖,转化和生存
NPTX2是一个长的正五聚神经元蛋白的一部分,它的另外两个部分包括NPTX1和NPTXR
AD患者脑部病变的特征之一就是具有NFL的阳性免疫组织化学表达,主要表现为高度磷酸化后的积累
在AD的发病机制中,自由基损伤神经元后会导致脂质过氧化,从而增加F2-异前列烷的产生
VILIP-1是高度表达的神经元钙离子感受器蛋白。研究发现AD患者CSF中VILIP-1水平显著增高,轻度和中度AD患者的VILIP-1水平没有明显差异
miR-29a / b-1簇的丧失与阿尔茨海默病中增加的BACE1活性相关,指向潜在的致病关联
有研究发现,AD患者脑脊液中tau蛋白的含量相对于正常对照组来说高2-3倍
神经炎性病变在AD病理生理过程中占据着很重要的地位,在AD进展过程中有一个推动作用。TNF-α可以促进T细胞产生各种炎症因子,进而促进炎症的发生
有许多研究检测AD患者血浆中的Aβ含量,将其作为一个生物标志物对待。但是目前已经有文献报告说血浆中Aβ的浓度无法预测临床的AD的发展,并且在试验样品中Aβ浓度与AD诊断前的浓度无明显变化,表明血浆中的Aβ含量不是用于鉴定AD风险的有用的生物标志物
AD患者的老年斑中可以检测到低密度受体相关蛋白-1(LRP1)。SLRP是LRP1的胞外段被剪切后释放入血浆的515KDa蛋白。SLRP是一种保护性蛋白,它可以阻止外周血中大部分Aβ蛋白通过血脑屏障进入脑内
Aβ蛋白起源于类淀粉前体蛋白(APP)。APP有三种不同的分子量亚型:130KDa,110KDa和106KDa
目前研究发现在AD患者和MCI患者血样测定和海马体积测量中,发现血液中低水平的APOE与海马体积的缩小存在明显的关系
突触降解、脑萎缩、神经元丢失、淀粉样斑块沉积和以神经原纤维缠结(nft)形式存在的tau蛋白凝结
在阿尔茨海默病中,神经元会发生退行性变化,导致认知功能障碍和脑容量减少
AD会导致失忆性认知障碍,而其他不常见的变异则会导致非失忆性认知障碍
NIA-AA提出可以计算AD患者的ABC评分。在该评分中,Braak tangle stage (B)解释了NFTs, modified Consortium to Establish a Registry for AD (C)表示神经样斑块,Thal淀粉样阶段表示β淀粉样斑块(a)
根据病理生理学,AD 的主要生物标志物被命名为 Aβ、tau 和神经退行性变生物标志物。在这个分类中,“A”代表基于淀粉样蛋白的生物标志物,如 CSF Aβ42 和淀粉样蛋白 PET,“T”代表 tau 生物标志物,如 tau PET 和 CSF p-tau,而 N 代表神经变性生物标志物,主要是结构 MRI、CSF t -tau 和氟脱氧葡萄糖 (FDG)-PET。其中,tau、Aβ 和淀粉样蛋白 PET 是病理生理生物标志物,而 MRI 和 FDG-PET 代表地形下游生物标志物。这些生物标志物可以表示为阳性和阴性,例如 A+/T+/N-。
Tau 蛋白是一种细胞内本质上无序的蛋白质,通过促进小管聚合来支持神经元细胞骨架和微管稳定性。Tau 是一种未折叠的蛋白质,会经历 PTM,这对于其定位和与其他蛋白质的相互作用至关重要。PTM 改变蛋白质的静电和电荷,从而改变结构并影响它们的功能、相互作用和聚集。磷酸化、甲基化和乙酰化等 PTM 调节 tau 的正常功能,但在 AD 的情况下,磷酸化会受到干扰。在人脑中,存在六种主要的 tau 蛋白亚型,它们是由于 tau mRNA 的 C 端和 N 端的可变剪接而形成的。N 端的选择性剪接会产生同种型,如 0N、1N 或 2N,而在 C 端,10 位外显子的剪接会形成两种变体,即 4R 和 3R 。2N4R 亚型是 tau 最长的亚型,具有大约 85 个磷酸化位点。磷酸化对于 tau 的正常功能至关重要,其中磷酸盐 (PO 4) 基团掺入发生在丝氨酸、酪氨酸或苏氨酸(极性氨基酸)残基处。磷酸化会增加负电荷(蛋白质中的亲水实体)和静电变化,从而进一步改变与其他蛋白质的相互作用、信号事件及其清除。微管结合域的丝氨酸 214 位和丝氨酸 262 位以及富含脯氨酸的域的苏氨酸 231 位的磷酸化降低了 tau 与微管的结合亲和力。
APP 是一种参与突触功能和信号传导的跨膜蛋白。它被分泌酶切割成长度在 37 到 43 个氨基酸之间的不同异构体,例如 Aβ40 和 Aβ42。在健康个体中,Aβ 的产生和清除之间存在平衡;然而,随着 Aβ 的产生增加或清除减少,AD 患者开始形成淀粉样斑块。这些可溶性 Aβ 低聚物促进突触退化,而厚斑块对脑实质造成毒性。失调的 Aβ 寡聚体可以通过抑制谷氨酸再摄取和引起神经元过度激活来诱发神经毒性。生化和结构研究显示 Aβ42 是 AD 患者所有弥散和老年斑中的主要形式,而 Aβ40 在 CSF 和脑细胞培养物中占优势。
Ng 是由来自钙调蛋白家族的 NRGN(神经粒素)基因蛋白编码的突触后 C 端肽。在皮质和海马区的树突棘中,Ng 在钙调蛋白的帮助下控制突触活动并保持其可塑性。突触退化导致 Ng 和钙调蛋白的结合效率降低,这会导致 Ca 2+传输受到干扰,从而导致认知能力下降。主要突触退化主要发生在中颞区。由于 AD 病理学导致 CSF 中的 Ng 从树突中渗出,因此 AD 患者皮质和海马区的 Ng 浓度增加。 钙蛋白酶和脯氨酰内肽酶是切割 Ng 的主要酶,这会降低细胞内 Ng 的浓度,从而导致其功能丧失和突触功能破坏。神经丝是一种对轴突生长至关重要的支架蛋白。神经丝存在于三个不同的亚基中,分别称为重神经丝 (NFH)、轻神经丝 (NfL) 和中神经丝 (NFM)。在 AD 中,CSF 中的 NfL 水平急剧增加,即比血液中的水平高 50 倍。
胶质纤维酸性蛋白 (GFAP) 是星形胶质细胞中的一种细胞骨架蛋白,也是由神经元损伤(星形胶质细胞增生)引起的异常星形胶质细胞活化和增殖的标志物。在 AD 前驱期发现星形胶质细胞增生围绕 Aβ 斑块。
APP生理和淀粉样蛋白分解产生的可溶性淀粉样前体蛋白(sAPP) α和β与AD的主要潜在病理生理事件相关。此前,很少有研究检查血浆中sAPP-α和sAPP-β浓度的变化是否与AD有关,并探索它们作为AD新型生物标志物的潜在作用。一项研究提供了进一步的证据,表明 sAPP-β 是一种很有前途的新型 AD 生物标志物,有可能提高传统生物标志物的诊断准确性,包括微创诊断过程。
文章来源:springer(DOI:10.1007/s10571-023-01330-y)、《阿尔茨海默病的临床诊断生物标志物和治疗进展》