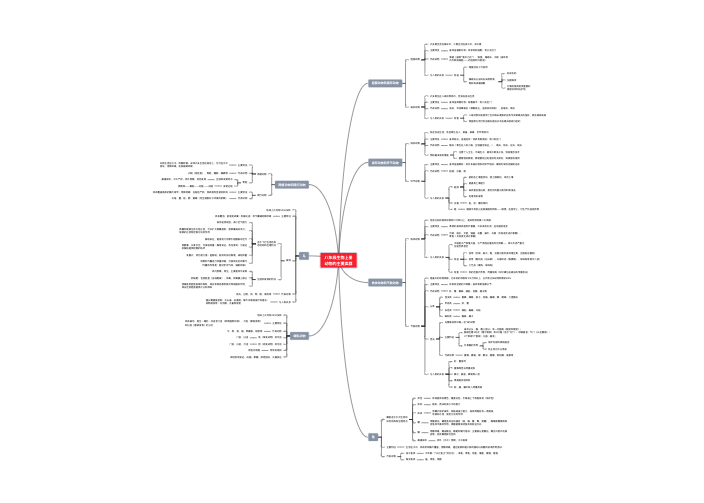
是机体免疫系统受抗原刺激后,淋巴细胞特异性识别抗原分⼦,发⽣活化、增殖、分化, 表现出⼀定⽣物学效应的全过程。
免疫应答最基本的生物学意义是识别“自身”与“非己”,并清除“非己”的抗原性物质,以保护机体免受抗原异物的侵袭
T细胞
B细胞
APC
淋巴结、脾脏等外周免疫器官是发生免疫应答的主要场所
特异性
多样性
记忆性
自限性
指抗原进入机体,经APC处理、加⼯,然后被抗原特异性淋巴细胞识别的阶段
指抗原特异性淋巴细胞受抗原刺 激⽽发⽣活化、增殖、分化,形成记忆细胞与效应细胞的阶段。
指抗原特异性淋巴细胞受抗原刺激⽽发⽣活化、增殖、分化,形成记忆细胞与效应细胞的阶段。
抗原识别受体(TCR)的基因重排,表达多样性的TCR
↓
双阴性时期(DN)
↓
双阳性时期(DP)
↓(阳性选择-MHC限制性)
单阳性时期(SP)
↓(阴性选择-自身耐受)
成熟T细胞
双阴性细胞向胸腺⽪质深层迁 移,先后发⽣TCRβ和TCRα基因重排和表达,这使CD4-CD8-细胞免于凋亡,并促使其逐渐发 育为CD4+CD8+双阳性细胞
若双阳性细胞的TCR能与胸腺⽪质细胞表⾯MHC Ⅱ或MHC Ⅰ类 分⼦以适当亲和⼒结合,即继续分化为CD4+或CD8+单阳性细 胞;
若双阳性细胞不能与MHC分⼦有效结合,则在胸腺⽪质中发⽣凋亡。
生物学意义:获得MHC限制性;DP→SP
经历阳性选择后的单阳性细胞与位于胸腺⽪质与髓质交界处 的树突状细胞和巨噬细胞(均⾼表达MHC I和MHC Ⅱ分⼦并提呈⾃身抗原)接触。若单阳性细胞能识别并⾼亲和⼒结合此 ⾃身抗原-MHC分⼦复合物,即 发⽣凋亡;
不能识别该复合物的单阳性细 胞则能继续发育。
生物学意义:清除⾃身反应性T细胞,保留多样性的抗原反应性T细胞,以 维持中枢耐受。
表达功能性TCR
⾃身MHC限制(识别⾃身MHC分⼦)
⾃身免疫耐受(不识 别⾃身Ag)
·V区识别pMHC
·胞内区很短,不能转导信号
·TCR识别pMHC时,既要识别抗原肽,也要识别自身MHC分子的的多态性部分,称为MHC限制性
TCR-pMHC
V区:CDRs (CDR1、CDR2→MHC;CDR3→肽)
由六条跨膜多肽链组成,胞内区较长,含有免疫受体酪氨酸活化基序(ITAM)
受体酪氨酸激活基序(ITAM)
功能:传递抗原活化信号,为TCR表达所必需
CD4 和 CD8 分子胞质区可结合酪氨酸蛋白激酶 p56lck,参与 TCR 识别抗原所产生的活化信号的转导过程。
辅助TCR识别抗原
参与信号转导(TCR共受体)
CD4是HIVgp120的受体
为T或B细胞完全活化提供共刺激信号的细胞表⾯分⼦及其配体。
第一信号由 TCR 识别 pMHC 而产生,经 CD3 转导信号,CD4 或 CD8 起辅助作用。
第二信号(或共刺激信号)由共刺激分子提供。只有第一信号没有共刺激信号,T 细胞不能活化而克隆失能。
CD28(ITAM激活效应)
CTLA4(ITIM抑制效应)
都与APC表面的B7分子(B7-1(CD80)、B7-2(CD86))结合
CD28 与 APC 表面的 B7-1(CD80)或 B7-2(CD86)结合。CD28 产生的共刺激信号在T 细胞活化中发挥重要作用。
表达于活化的 T 细胞表面,配体也是 CD80 和 CD86,但亲和力高于 CD28(故表现抑制)。
其胞浆区含有免疫受体酪氨酸抑制基序(ITIM)。
通常 T 细胞活化后才表达 CTLA-4,其作用是下调或终止 T 细胞活化。
表达于活化的 T 细胞表面,配体为 ICOSL(位于APC上)。在 CD28 后起作用,能调节活化 T 细胞多种细胞因子的产生,并促进 T 细胞增殖
PD-1 表达于活化的 T 细胞,配体为 PD-L1 和 PD-L2。可抑制 T 细胞增殖以及 IL-2 和IFN-γ 等细胞因子产生,还参与外周免疫耐受。
表达于活化的 CD4+T 细胞表面,与 APC 表面的 CD40 结合后,促进 APC 活化,也促进 T细胞活化。
活化 Th 细胞表达的 CD40L 与 B 细胞表面的 CD40 结合可促进 B 细胞的增殖、分化、抗体生成和抗体类别转换,诱导记忆性 B 细胞的产生。
注意:CD40-CD40L——B细胞活化的主要共刺激信号
B7-CD28——T细胞活化的主要共刺激信号
BTLA 、CD2、LFA-1 和 ICAM-1
第三信号-微环境
丝裂原:多为植物糖蛋⽩或细菌产物,对淋巴细胞有⾮特异的多克隆刺激作⽤。
有丝分裂原特性:不同丝裂原对T、B的作⽤有⼀定的选择性
临床意义:细胞免疫功能测定、淋巴细胞转化试验
外周⾎ T + PHA/ConA → 孵育→ T细胞分裂增殖
1. 初始 T 细胞(naïve T cell)--未经抗原刺激的成熟 T 细胞。
2. 效应 T 细胞(effector T cell)--应答产生,行使免疫效应。
3. 记忆 T 细胞(memory T cell, Tm)--应答产生,介导再次免疫应答。
占 T 细胞总数 95%以上,识别由 MHC 分子提呈的蛋白质抗原,具有 MHC 限制性,是介导细胞免疫及免疫调节的主要细胞。
占 T 细胞总数的 5%以下,多为 CD4-CD8-,主要分布于皮肤和黏膜组织,其抗原受体缺乏多样性,识别抗原无 MHC 限制性,主要识别 CD1 分子提呈的糖脂、某些病毒的糖蛋白、分枝杆菌的磷酸糖和核苷酸衍生物,热休克蛋白等,具有抗感染和抗肿瘤作用,还可以发挥免疫调节作用和介导炎症反应。
CD4+T 细胞受自身 MHCⅡ类分子的限制,活化后分化为 Th 细胞。
CD8+T 细胞受自身 MHCⅠ类分子的限制,活化后分化为细胞毒性 T 细胞。
1. 辅助 T 细胞(helper T cell, Th)
通常所称的 CD4+T 细胞即指 Th,根据其功能不同又可分为不同的亚群:
主要分泌 IFN-γ、TNF、IL-2 等,可辅助 CTL和M 的激活,介导细胞免疫。其分泌的细胞因子也可促进 Th1 进一步增殖并抑制 Th2 增殖。
主要分泌 IL-4、IL-5、IL-10 及 IL-13 等,辅助 B 细胞活化,也促进 Th2 细胞增殖抑制 Th1 增殖。
通过分泌 IL-17、IL-21、IL-22、IL-26、TNF-等多种细胞因子参与固有免疫和某些炎症的发生,特别是在自身免疫病中起重要作用。
(4)Tfh(follicular helper T cell)
存在于外周免疫器官淋巴滤泡,其产生的 IL-21 在 B 细胞分化为浆细胞、产生抗体和Ig 类别转换中发挥重要作用,是辅助 B 细胞应答的关键细胞。
2. 细胞毒性 T 细胞(cytotoxic T lymphocyte, CTL,又称 Tc)
CTL 表达 CD8,主要功能是特异性识别内源性抗原肽-MHCⅠ类分子复合物,进而通过穿孔素(perforin)、颗粒酶(granzyme)和 FasL 等杀伤靶细胞。
杀伤机制:a.释放穿孔素,致靶细胞裂解、死亡;
b.释放颗粒酶,借助穿孔素的孔道进 ⼊ 靶细胞,导致靶细胞凋亡;
c. CTL⾼表达FasL,通过Fas/FasL 途径诱导细胞凋亡
3. 调节性 T 细胞(regulatory T cell, Treg)
通常所称的 Treg 是 CD4+CD25+的 T 细胞。
Foxp3 是一种转录因子,不仅是 Treg的重要标志,也参与 Treg 的分化和功能。
Treg 主要通过两种方式负调控免疫应答:
·直接接触抑制靶细胞活化;
·分泌 TGF-β、IL-10 等细胞因子抑制免疫应答。
(1) 自然调节性 T 细胞(natural Treg, nTreg)
直接从胸腺中分化而来。占外周血 CD4+T 细胞的 5%~10%。nTreg 的表型为
CD4+CD25+Foxp3+,通过细胞接触和分泌细胞因子,从而抑制自身反应性 T 细胞介导的病理性应答。
(2) 诱导性调节性 T 细胞(inducible Treg, iTreg)
又称适应性调节性 T 细胞,由初始 T 细胞在外周诱导分化而来,包括多种亚群。Th3以分泌大量 IL-4,IL-10 和 TGF-β 为特征,起免疫抑制作用,通常在口服耐受和粘膜免疫中发挥作用。Tr1 在体外由高浓度的 IL-10 诱导而来,主要分泌 TGF-β,可抑制炎症性滋生免疫反应。
指能够加⼯抗原,并以抗原肽 -MHC 分⼦复合物的形式将抗原肽提呈给 T 淋巴细胞的⼀类细胞
通过MHC-Ⅰ分子提呈内源性抗原
①树突状细胞(dendritic cell, DC):体内抗原提呈功能最强大的 APC,其特点是能够刺激初始 T 细胞的活化和增殖分化。
②巨噬细胞:能有效地加工提呈胞外病原体和颗粒性抗原。巨噬细胞主要是激活效应 T 细胞,同时也受 T 细胞的激活,更有效地杀伤摄入的病原体和介导炎症作用
③B 细胞:可通过抗原受体 BCR 浓集和摄取抗原,因此能有效加工和提呈低浓度的抗原。B 细胞主要是向效应 T 细胞提呈抗原,并通过与 T 细胞的相互作用,接受 Th 的辅助作用,进入自身的活化、增殖与分化。
兼职APC
T细胞与APC的特异性结合
T细胞与APC的非特异结合,LFA-1,CD2与ICAM-1,LFA-3 。
LFA-1构象改变,增强与ICAM-1的亲和力,稳定并延长T细胞与APC间结合的时间。
是T细胞膜表由⼀组TCR及其周围的黏附分⼦构成的⼀个特殊结构,可增 强TCR与抗原肽-MHC复合物结合的亲和⼒,促进T细胞信号转导,参与T细胞的激活 和细胞效应的有效发挥。
过程:需被加工的胞浆蛋白
↓泛素化
呈线性进入蛋白酶体
↓
短肽
↓ 经ER膜上的抗原加工相关转运物(TAP)
进入ER与新组装的MHC-Ⅰ类分子结合
↓
到达APC表面
MHCⅠ类分子a链和 β2 微球蛋白(β2m)在内质网中合成,α链在伴随蛋白(钙联蛋白)的帮助下折叠成立体结构并与 β2m 组装成完整的 MHCⅠ类分子。 当抗原肽通过 TAP 进入内质网时,合适的肽就与 MHCⅠ类分子结合形成 pMHC。
APC 摄取抗原的方式有吞噬、胞饮、受体介导的内吞作用和内化等。摄取的蛋白质抗原在内体(endosome)
在内质网中合成的 MHCⅡ类分子α链和 β 链,在伴随蛋白的帮助下折叠装配形成 α、 β 异二聚体。参与 MHCⅡ类分子装配的伴随蛋白主要有钙联蛋白和 Ii 链。
Ii 链即 Ia 分子相关的不变链(Ia-associated invariant chain)的简称。
它的作用主要有三个方面:帮助MHCⅡ类分子折叠和装配;其 CLIP 部分阻止 MHCⅡ类分子在内质网与其它内源性多肽结合;引导 MHCⅡ类分子转运到内体。
在内体中,由 HLA-DM 分子辅助使 CLIP 与抗原肽结合槽解离,MHCⅡ类分子与合适的抗原肽结合,形成稳定的抗原肽-MHCⅡ类分子复合物,载有 MHCⅡ类分子/抗原肽复合物的小泡通过胞吐空泡的形式与细胞膜融合,pMHCⅡ表达于抗原提呈细胞表面。
1. 抗原的交叉提呈(cross-presentation),是指 MHCⅠ类分子提呈外源性抗原与 MHCⅡ类分子提呈内源性抗原的形式。
2. CD1 分子的抗原提呈,CD1 提呈脂类和糖脂抗原给 CD4-CD8-的 T 细胞和 NK T 细胞等。
TCR对抗原的识别具有特异性和 MHC限制性。MHC限制性决定了T细胞仅识别 由同⼀个体APC表⾯的MHC分⼦提呈的抗原肽。
进入外周淋巴组织的T细胞与APC
↓ (通过黏附分子发生非特异性短暂黏附)
TCR对APC表面各种pMHC进行筛选→TCR不识别pMHC,两个细胞就分离
↓
如果能特异性识别而结合,形成免疫突触
免疫突触:中央为成簇的 TCR-肽-MHC 以及 CD4 或 CD8,周围为 LFA-1-ICAM-1 等黏附分子。
第一信号:TCR-CD3 复合受体识别 pMHC 后,通过 CD3 分子的胞内段传入抗原特异性信号。
第二信号:最主要的共刺激分子是 APC 表面 B7 与 T 细胞表面的 CD28 之间的相互作用。其它分子对如 ICOS 与 ICOSL、CTLA-4 与 B7、PD-1 与 PD-L1 等,也参与第二信号的产生或抑制。
如果T细胞只接受第1信号而无法接受第2信号,则不能被激活,而且还可被诱导凋亡或进入失能状态。
这一特性具有重要的生物学意义,涉及自身免疫耐受和肿瘤免疫逃逸等。
3、细胞因⼦促进T细胞增殖和分化,尤其IL-2
概念:胞外刺激信号传递⾄细胞内部,使转录因⼦( 基因,这⼀过程称为信号转导 NFAT、NF-B、AP-1)活化,转位到细胞核内,活化相应分子和过程 。
pMHC 与 TCR 结合,使 TCR 有关的 CD3、CD4 或 CD8 等分子交联,偶联于其胞内段的 PTK(Lck、Fyn)聚集而激活。活化的 Lck、Fyn 使 CD3 分子胞内段的的 ITAM 发生磷酸化。
ITAM 的酪氨酸残基发生磷酸化后,就能够结合胞浆游离性 PTK(ZAP-70),使 ZAP-70被招募(recruit)至细胞膜内侧并被受体相关性 PTK 所激活。
在双信号和细胞因子(IL-2 与高亲和力 IL-2 受体)的作用下,活化 T 细胞增殖
T细胞扩增:活化的T细胞表达高亲和力IL-2受体,细胞增殖
初始 CD4+T 细胞在接受抗原刺激后先分化成 Th0 细胞,在微环境中各种因素的影响下,Th0 进一步向各类效应细胞分化。IL-12 和 IFN-γ 等可诱导向 Th1 分化,IL-4 等可诱导向 Th2 分化,TGF-β 和 IL-6(小鼠)或 IL-1β 和 IL-6(人)等可诱导向 Th17 分化,IL-21和 IL-6 能诱导向 Tfh 分化,。TGF-β 和 IL-2 可诱导向 Treg 分化。
CD8+ T 细胞在 Th1 细胞的辅助下分化为 CTL(Tc),表达颗粒酶(granzyme)、穿孔素(perforin)、FasL 及细胞因子 IFN-γ、TNF-α、TNF-β 等基因,形成富含穿孔素和颗粒酶的膜结合型细胞浆颗粒。
记忆T细胞产生:免疫记忆是适应性免疫的重要特征。
效应T细胞:
效应细胞在感染的组织中发挥作⽤
效应细胞发挥作⽤时可以不需要第⼆信号
Th1、Th17 和 CTL 细胞主要在细胞免疫应答效应阶段发挥作用。
Th2 和 Tfh 细胞则主要辅助 B 细胞而参与体液免疫应答。
效应CTL分泌穿孔素(perforin)和 粒酶(granzyme),穿孔素在靶细胞膜 上形成孔道,使靶细胞裂解;颗粒酶 通过孔道进⼊细胞,激活凋亡相关 酶系统介导靶细胞凋亡。
效应CTL表达FasL;分泌 TNF-,激活caspase信号转导途 径,诱导靶细胞凋亡。
CTL 通过 TCR 特异性识别靶细胞表面 pMHCⅠ后,诱导 CTL 表达的粘附分子从低亲和力转向高亲和力状态,与靶细胞细胞之间形成紧密接触。
同时,CTL 膜表面分子和胞内分泌性的细胞器,包括细胞骨架、高尔基体、胞浆颗粒等,向效-靶细胞紧密接触的部位重新排列和分布,即 CTL 极化。
CTL胞质颗粒中的效应分⼦释放到效-靶结合部位
T 细胞在与靶细胞紧密接触的连接处通过胞吐(exocytosis)作用释放胞浆中
的颗粒,颗粒中含有穿孔素和颗粒酶等。穿孔素可插入靶细胞膜上聚合形成贯通细胞膜的孔道。颗粒酶等则通过穿孔素形成的通道进入靶细胞内,诱导靶细胞凋亡(apoptosis)。
活化的 CTL 膜上表达 FasL,与靶细胞膜上的 Fas 结合,导致靶细胞凋亡。
CTL 通过分泌 TNF 等细胞因子,与靶细胞上的 TNF 受体等结合,也可
导致靶细胞凋亡。
CD8效应T细胞不需协同刺激分⼦就能发挥作⽤
Th1分泌L3和GM-CSF诱导骨髓产生和释放单核细胞与中性粒细胞;分泌FN-y、TNF和MCP.1、MIF等能诱导局部血管内皮细胞高表达黏附分子和发挥趋化作用,有利于血管内的单核细胞和中性粒细胞外渗(extravasate)穿过血管壁并游走至炎症部位。
Th1细胞通过表达CD40L与巨噬细胞表面CD40相互作用,以及通过分泌 IFN-γ 和 TNF-β 等,激活单核巨噬细胞有效地吞噬和杀伤病原体和介导炎症反应,并更有效地向新的 T 细胞提呈抗原,增强和放大 T 细胞免疫应答。
参与超敏反应炎症
1.活化诱导的细胞死亡(activation induced cell death, AICD)
活化的 T 细胞高表达 FasL,FasL 存在膜型与分泌型二种类型,不仅诱导靶细胞凋亡,也可与自身以及周围淋巴细胞表面的 Fas 结合,诱导淋巴细胞的凋亡。
这一机制可以控制特异性 T 细胞克隆的过度扩增,维持免疫平衡,可能也是外周免疫耐受建立过程中克隆清除的重要机制。
活化的淋巴细胞高表达各种受体,需要细胞因子、抗原刺激和协同刺激分子的刺激才能维持生存。当免疫应答导致感染被消除后,由于这些刺激因素的减少导致“受体饥饿”,通过线粒体途径诱导细胞凋亡,这种凋亡又称程序性细胞死亡(programmed cell death, PCD),可以使免疫细胞在完成清除病原体的任务后得以自我限制。
抗感染:细胞内寄生的病原体
抗肿瘤:
CTL对肿瘤细胞的杀伤
细胞因⼦对肿瘤的直接作⽤
细胞因⼦激活巨噬细胞或NK细胞
免疫病理作用:迟发型超敏反应、移植排斥反应、自身免疫病