概念:蛋白质是由许多氨基酸通过肽键相连的高分子含氮化合物
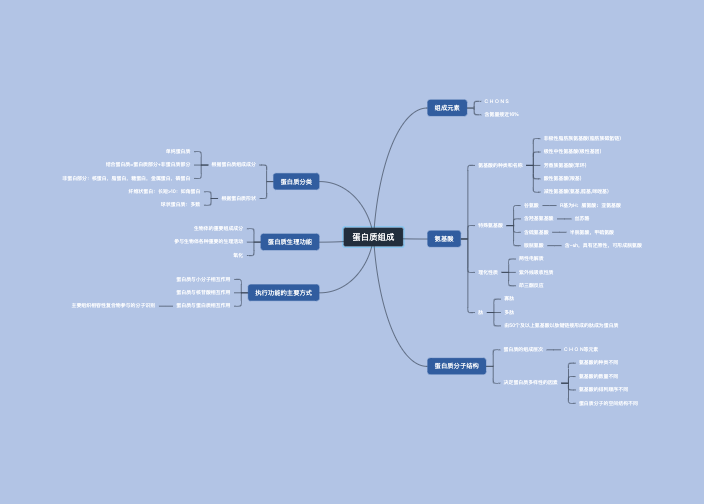
组成元素:C、H、O、N、S,有些蛋白质有少许的P或者金属元素,个别蛋白质含有碘
含氮量平均为16%
蛋白质含量=氮含量/16%=氮含量*6.25
参与蛋白质合成有20种氨基酸,通常是L-α-氨基酸(甘氨酸除外)
体内不参与蛋白质合成的L-α-氨基酸:鸟氨酸、瓜氨酸、精氨酸琥珀酸
脯氨酸、缬氨酸、异亮氨酸、亮氨酸、丙氨酸、甘氨酸、甲硫氨酸(蛋氨酸)
妃子携一两铺假饼干
集中拌天骨酥丝
芳香老本色
酸谷天
拣来精(心)组(合)
含2个氨基的氨基酸
含2个羧基的氨基酸
亚氨基酸
不易形成α螺旋
无游离的氨基
天然蛋白质中不存在的氨基酸
不出现于蛋白质中的氨基酸
核酸是260nm
不属于L-α-氨基酸
极性最强
甲硫氨酸、半胱氨酸
赖氨酸
天冬氨酸、谷氨酸
在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的 pH称为该氨基酸的等电点
pI=(pK1+pK2)/2
不移动,稳定性最差(净电荷=0)
向负极移动
向正极移动
要有共轭双键(苯环)才可有吸收峰
产物最大吸收峰为570nm附近
用作氨基酸定量分析
1分子甘氨酸的α-羧基和1分子甘氨酸的α-氨基脱去1分子水缩合成为甘氨酰甘氨酸
连接两个氨基酸的酰胺键称为肽键
肽键N上的H、C上的O都参与氢键的合成
-N-C-C-
氨基端→羧基端(N→C)
第一个肽键是非α肽键
半胱氨酸的疏基是该化合物的主要功能基团
巯基有还原性,有抗氧化作用
一级结构
二、三、四级结构
由一条肽链形成的蛋白质只有一级、二级和三级结构
由2条或2条以上肽链形成的蛋白质才有四级结构
单纯蛋白质
四级结构不一定都有辅基
结构蛋白
功能蛋白
氨基酸N→C的排列顺序
肽键,(二硫键也属于)
储存蛋白质折叠的所有信息
连接牛胰岛素AB链的是二硫键
蛋白质分子中某一段肽链的局部空间结构
不涉及氨基酸残基侧链的构象
氢键
α-螺旋
β-折叠
β-转角
Ω环
二级结构主要形式
参与肽键的6个原子位于同一平面,C1和C2为反式构型
顺时针方向(右手螺旋)
氨基酸侧链伸向螺旋的外侧,每3.6个氨基酸残基螺旋上升一圈,螺距为0.54nm。
每个肽键的N一H和第4个肽键的羰基氧形成氢键
氢键的方向与螺旋长轴基本平行
呈折纸状
多肽链充分伸展,每个肽单元以Cα为旋转点,依次折叠成锯齿状结构
反向走向通过形成氢键来稳固结构
蚕丝蛋白几乎都是β-折叠结构
许多蛋白质既有α-螺旋,又有β-折叠结构
存在于球状蛋白质
由4个氨基酸残基组成
第二个氨基酸残基通常是脯氨酸
存在于蛋白质分子的表面
以亲水残基为主
分子识别
整条肽链中全部氨基酸残基的相对空间位置
疏水键、盐键、氢键、范德华力
结构域
蛋白质分子中具有特定空间构象和特定功能的结构成分
具有特殊功能的超二级结构
结合钙离子的模体
锌指结构
亮氨酸拉链
球状蛋白质的独立折叠单位,有较为独立的三维空间结构
协助多肽链进行正确折叠的辅助蛋白质
在二硫键形成有重要作用
许多功能性蛋白质有两条或两条以上的多肽链
每一条多肽链都有其完整的三级结构
只有在四级结构才可说亚基
氢键、离子键
有2个以上亚基构成的蛋白质,单一亚基一般没有生物学功能
结构蛋白
物质运输
催化功能
信息交流
免疫功能
氧化供能
维持机体的酸碱平衡
维持正常的血浆渗透压
功能蛋白
蛋白质分子发生变异所导致的疾病
有基因突变
谷氨酸 → 缬氨酸
别构效应
一级结构不变,蛋白质的构象发生改变
由朊病毒蛋白引起
处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子,净电荷为零,此时溶液的 pH称为蛋白质的等电点
解离成阴离子
胶体性质
阻断蛋白质颗粒的相互聚集,防止溶液中蛋白质沉淀析出
起胶粒稳定的作用
不涉及一级结构氨基酸排序的改变
溶解度降低、黏度增加、结晶能力消失,生物活性丧失,易被蛋白酶水解
加热、乙醇、强酸,强碱、重金属离子、生物碱试剂等
蛋白质的复性若蛋白质变性程度较轻,去除变性因素后,有些蛋白质仍可恢复或部分恢复其原有的构象和功能,称为复性
但是许多蛋白质变性后,空间构象被严重破坏,不能复原,称为不可逆性变性
蛋白质的沉淀
蛋白质的凝固
280nm
蛋白质水解后产生的氨基酸可发生茚三酮反应
蛋白质和多肽分子中的肽键在稀碱溶液中与硫酸铜共热,呈现紫色或红色